
11. Sınıf Fen Lisesi Kimya Ders Kitabı Cevapları Sayfa 85


“11. Sınıf Kimya Ders Kitabı Cevapları Fen Lisesi Sayfa 85 Meb Yayınları” ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
11. Sınıf Fen Lisesi Kimya Ders Kitabı Cevapları Sayfa 85
45. İyonlaşma enerjisi nedir? 2. periyot elementlerinin iyonlaşma enerjisi-atom numarası grafiğini çiziniz.
- Cevap:
İyonlaşma enerjisi, bir atomun en dıştaki elektronunun nötral atomdan ayrılması için gerekli olan enerjidir. Yani, bir atomun bir elektronunu çıkarmak için uygulanan enerjidir. İyonlaşma enerjisi, bir atomun elektropozitifliği ya da elektro negatifliği hakkında bilgi verir.
İyonlaşma enerjisi, bir elementin farklı yörüngelerindeki elektronların çıkarılması için farklı değerlere sahip olabilir. Birinci iyonlaşma enerjisi, en dıştaki elektronu çıkarmak için gerekli olan enerjidir. İkinci iyonlaşma enerjisi, bir atomun en dıştaki elektronunu çıkardıktan sonra, bir sonraki elektronu çıkarmak için gerekli olan enerjidir. Bu enerji düzeyi, birinci iyonlaşma enerjisinin daha yüksek olma eğilimindedir.
İyonlaşma enerjisi, bir elementin kimyasal özelliklerine de bağlıdır. Daha yüksek iyonlaşma enerjisi değerleri olan elementler, diğer elementlerle kimyasal reaksiyonlarda daha az aktif olma eğilimindedirler. Örneğin, inert gazlar olarak bilinen helyum, neon, argon, krypton, ksenon ve radon, en dıştaki elektronlarının çıkarılması çok zor olduğundan, diğer elementlerle neredeyse hiçbir kimyasal reaksiyona girmezler.
46. 11Na, 12Mg, 13Al atomlarının 1 ve 2. iyonlaşma enerjilerini karşılaştırınız.
- Cevap:
İE1: Mg > Al > Na
İE2: 11Na+> 13Al+> 12Mg+
47. Elektron ilgisi ve elektronegatiflik kavramlarını açıklayınız.
- Cevap:
Elektron ilgisi ve elektronegatiflik, elementlerin kimyasal özelliklerini anlamada kullanılan iki önemli kavramdır.
Elektron ilgisi, bir nötral atomun bir elektron eklenmesi durumunda salınan veya emilen enerji miktarını ifade eder. Elektron ilgisi negatif bir değerle ifade edilir ve bir elementin elektron ilgisi değeri, elementin elektronegatifliği hakkında bilgi verir. Bir elementin elektron ilgisi değeri ne kadar yüksekse, o kadar elektro negatif bir elementtir. Çünkü, yüksek elektron ilgisi değeri, bir elementin bir elektron kazanma eğilimini gösterir.
Öte yandan, elektronegatiflik, bir atomun diğer atomlarla bağ oluşturma eğilimidir. Elektronegatiflik, bir elementin nükleer çekirdeğinin etrafındaki elektronların çekim gücüne bağlıdır. Elektronegatifliği yüksek olan elementler, diğer elementlerle daha güçlü bağlar oluşturma eğilimindedirler. Genellikle, elektronegatifliği yüksek olan elementler, elektron çekme eğilimindedirler ve elektron ilgisi değerleri de yüksektir.
Elektron ilgisi ve elektronegatiflik, bir elementin kimyasal özelliklerinin yanı sıra, bir bileşiğin özelliklerini de belirleyebilir. Örneğin, bir elementin elektronegatifliği yüksekse, o elementin bir bileşikte bulunan diğer elementler üzerinde daha büyük bir elektron çekme gücü vardır. Bu da bileşikteki bağın polarizasyonunu artırarak, bileşiğin bazı özelliklerini etkiler.
48. 12Mg, 16S, 19K atomlarının elektron ilgilerini ve elektronegatiflerini karşılaştırınız.
- Cevap:
12Mg atomunun elektron ilgisi: +0.79 eV 16S atomunun elektron ilgisi: -2.08 eV 19K atomunun elektron ilgisi: +0.5 eV
Elektron ilgisi değerleri incelendiğinde, 16S atomunun diğer iki atoma kıyasla daha yüksek bir elektron ilgisi değerine sahip olduğu görülür. Bu, kükürt atomunun bir elektron kazanmaya daha fazla eğilimli olduğunu gösterir.
Elektronegatiflik değerleri ise Pauling ölçeği kullanılarak verilir.
12Mg atomunun elektronegatifliği: 1.31 16S atomunun elektronegatifliği: 2.58 19K atomunun elektronegatifliği: 0.82
Elektronegatiflik değerleri incelendiğinde, 16S atomunun diğer iki atoma kıyasla daha yüksek bir elektronegatiflik değerine sahip olduğu görülür. Bu, kükürt atomunun bir bileşik içinde diğer atomlarla daha güçlü bağlar kurma eğiliminde olduğunu gösterir.
49. Aşağıda verilen tepkimeleri tamamlayınız.
Na2O(k) + H2O(s) ➢ 2NaOH(aq)
CaO(k) + H2O(s) ➢ Ca(OH)2(aq)
CO2(g) + O(s) ➢ CO3^2-(aq)
SO3(g) + H2O(s) ➢ H2SO4(aq)
CO(g) + H2O(s) ➢ H2(g) + CO2(g)
50. Aşağıda baş grup elementlerinden K, L, M, N’nin ilk beş iyonlaşma enerjileri kJ/mol olarak verilmiştir.
a) Elementlerin alabileceği değerlik elektron sayısını ve bulunabileceği grubu bulunuz.
- Cevap: İlk beş iyonlaşma enerjileri incelendiğinde, K ve L elementleri sadece bir değerlik elektronuna sahiptirler, bu nedenle grubu 1A olarak bulunur. M elementi üç değerlik elektronuna sahiptir, bu nedenle grubu 3A’dır. N elementi beş değerlik elektronuna sahiptir, bu nedenle grubu 5A’dır.
b) K elementinin atom numarası kaçtır?
- Cevap: K elementinin atom numarası, K elementinin 1. iyonlaşma enerjisine karşılık gelen proton sayısıdır. Bu nedenle, K elementinin atom numarası 19’dur.
c) M elementinin 17Cl elementi ile yapacağı bileşiğin formülü nedir?
- Cevap: M elementinin 17Cl elementi ile yapacağı bileşiğin formülü, M elementinin üç değerlik elektronu olduğundan ve Cl elementinin bir değerlik elektronu olduğundan, MCl3 şeklindedir.
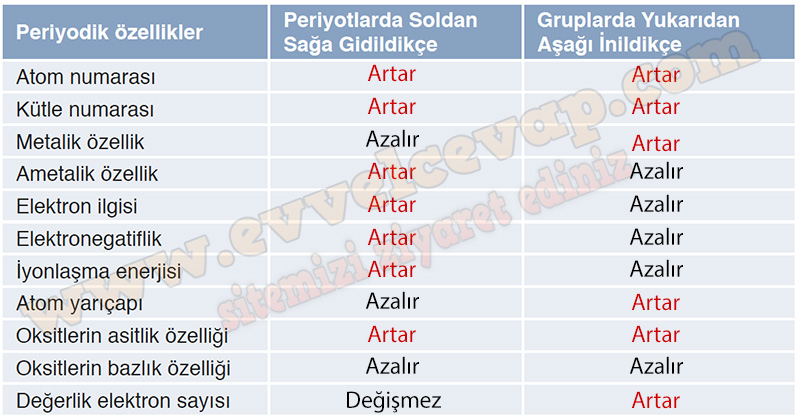
51. Aşağıda verilen periyodik özellikler gruplarda ve periyotlarda nasıl değişir? “Artar, azalır veya değişmez” ifadelerini kullanarak tabloyu doldurunuz.
- Cevap:
11. Sınıf Fen Lisesi Kimya Ders Kitabı Cevapları Sayfa 85 Meb Yayınları ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































