
11. Sınıf Kimya Beceri Temelli Etkinlik Kitabı Cevapları Sayfa 17


11. Sınıf Kimya Beceri Temelli Etkinlik Kitabı Sayfa 17 Cevapları Meb Yayınları‘na ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
11. Sınıf Kimya Beceri Temelli Etkinlik Kitabı Cevapları Sayfa 17
Tabloya bakarak elementlerin artan atom numarasına karşı, 1. iyonlaşma enerjilerinin değişimini gösteren bir grafik çiziniz ve çizdiğiniz grafiğe bağlı kalarak aşağıdaki soruları cevaplayınız.
1. Çizdiğiniz grafiği incelediğinizde aynı periyotta bulunan elementlerin atom numaralarının arttığı yönde genellikle 1. iyonlaşma enerjilerinin de arttığı görülmektedir. Ancak bazı bölgelerde yaşanan düşüşlerin sebebi nedir?
- Cevap: Düşüşlerin olduğu bölgelere dikkat edildiğinde 2A grubundan 3A grubuna geçiş sırasında ya da 5A grubundan 6A grubuna geçiş sırasında olduğu görülmektedir. 2A grubu ve 5A grubu elementlerinin küresel simetri özelliği göstermesi sebebiyle kazandıkları kararlılık, iyonlaşma enerjilerinin daha yüksek olmasına sebebiyet vermektedir.
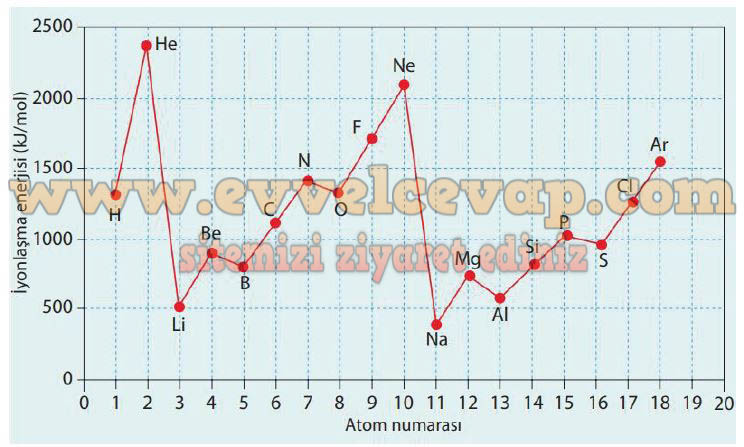
2. He ve Ne atomları ile kendilerinden hemen sonra gelen Li ve Na atomlarının 1. iyonlaşma enerjilerini kıyasladığımızda büyük bir değişimin olma sebebini açıklayınız.
- Cevap: K elementi ile Na elementi aynı grupta ve benzer kimyasal özelliklere sahiptirler. K elementinin atom hacmi, Na elementinin atom hacminden daha büyük olduğundan K elementinin
1. iyonlaşma enerjisi Na elementinin 1. iyonlaşma enerjisinden büyük olamaz.
3. Atom numarası 19 olan K elementinin 1.iyonlaşma enerjisinin neden 500 kj den fazla olmayacağını gerekçesiyle açıklayınız.
- Cevap: Li ve Na elementleri kendilerinden bir önce gelen He ve Ne elementlerine göre bir alt periyottadır ve katman sayıları dolayısıyla çapları He ve Ne atomlarına göre büyüktür. Ayrıca Li ve Na elementlerinin elektron verme eğilimi fazla olduğundan bu elementlerden elektron koparmak için harcanması gereken enerji, soygaz kararlılığında olan He ve Ne elementlerine göre oldukça düşüktür.
4. He atomunun 1. iyonlaşma enerjisinin diğer tüm elementlerin 1. iyonlaşma enerjisinden büyük olmasının sebebini nasıl açıklarsınız?
- Cevap: Elementlerin 1. iyonlaşma enerjisi, kimyasal kararlılığı ile doğru, atom hacmi ile ters orantılıdır. He, hem kararlılığı yüksek hem de atom hacmi küçük bir element olduğu için 1.iyonlasma enerjisi en yüksektir.
11. Sınıf Meb Yayınları Kimya Beceri Temelli Etkinlik Kitabı Sayfa 17 Cevabı ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































