
11. Sınıf Meb Yayınları Kimya Ders Kitabı Sayfa 146 Cevabı

“11. Sınıf Kimya Ders Kitabı Sayfa 146 Cevapları Meb Yayınları” ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
11. Sınıf Meb Yayınları Kimya Ders Kitabı Sayfa 146 Cevabı
3.3.1. ETKİNLİK
SAF SUYUN VE FARKLI DERİŞİMDEKİ ÇÖZELTİLERİN KAYNAMA NOKTALARININ KARŞILAŞTIRILMASI
Araç ve Gereç
• Saf su
• 3 ve 6 molal’lik NaCI çözeltileri
• 3 ve 6 molal’lik C6H12O6 çözeltileri
• Kaynama taşı
• Termometre
• Beherglas (5 adet)
• Sacayak
• Kibrit
• Bunzen beki veya ispirto ocağı
ETKİNLİĞİN AMACI
Suyun ve farklı derişimdeki çözeltilerin kaynama noktalarının bulunması ve sonuçların karşılaştırılması.
ETKİNLİK BASAMAKLARI
1. Beherglasa 250 mL su doldurulur. İçine 1-2 tane kaynama taşı atılır ve termometre yerleştirilir (Termometre kabın dibine değmemesi için bir mantarla veya destekle tutturulur.) (Görsel 3.3.7).
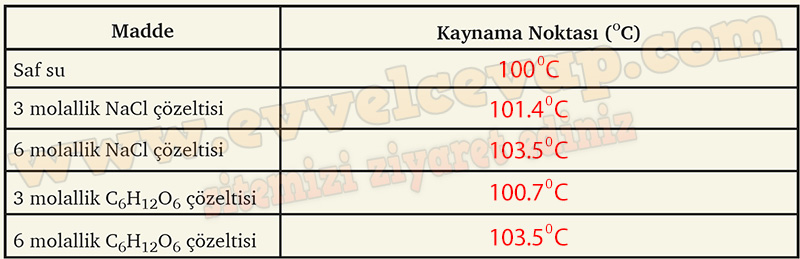
2. Beherglas ısıtılır. Suyun kaynamaya başladığı sıcaklık aşağıdaki tabloya not edilir.
3. Yukarıdaki her iki basamak 3 ve 6 molallik NaCI ve C6H12O6 çözeltileri için de yapılarak bulunan değerler aşağıdaki tabloya not edilir.
- Cevap:
ETKİNLİĞİN SONUÇLANDIRILMASI
1. Aynı maddenin farklı derişimlerde kaynama noktalarının farklı olmasının nedenini açıklayınız.
- Cevap: Aynı maddenin farklı derişimlerde kaynama noktalarının farklı olmasının nedeni, çözücüdeki çözünenin molal derişiminin artmasıyla kaynama noktasının da artmasıdır. Çözeltide daha fazla çözünen madde olduğunda, su molekülleri ile çözünen madde arasındaki bağlar artar ve bu nedenle kaynama noktası artar.
2. Farklı maddelerin eşit derişimli çözeltilerinin kaynama noktalarının farklı olmasının nedenini açıklayınız.
- Cevap: Farklı maddelerin eşit derişimli çözeltilerinin kaynama noktalarının farklı olmasının nedeni, çözünenin çözücü ile arasındaki çekim kuvvetlerinin farklı olmasıdır. Farklı maddeler, farklı moleküler yapıya sahip olduklarından, çözücü ile farklı şekillerde etkileşime girerler ve bu da kaynama noktasını etkiler.
3. Derişim ve kaynama noktası arasındaki ilişkiyi açıklayınız.
- Cevap: Daha yüksek derişimlerde çözünen madde, çözücü ile daha güçlü etkileşime girer. Bu, su molekülleri ile çözünen madde arasındaki bağların artması ve bu nedenle kaynama noktasının artması ile sonuçlanır. Dolayısıyla, çözeltinin molal derişimi arttıkça, kaynama noktası da artar.
NELER KAZANILDI?
1. Aşağıda maddelerin çözeltileri hazırlanıyor. Hazırlanan çözeltilerin molaliteleri eşit olduğuna göre kaynama noktalarını ve donma noktalarını büyükten küçüğe doğru karşılaştırarak farklılığın nedenini açıklayınız. I. CH3OH II. CaCO3 III. MgF2 IV AlCl3 V C2H5OH
- Cevap: kaynama noktası IV>III>II>I=V, donma noktası IV<III<II<I=V, kaynama noktası yükselmesi ve donma noktası düşmesi maddenin çözeltide oluşturduğu tanecik sayısı ile doğru orantılıdır. CH3OH: 1, CaCO3: 2, MgF2: 3, AlCl3: 4, C2H5OH: 1 tanecik oluşturur
2. 0,2 mol glikozun 1,8 mol suda çözünmesi ile oluşan çözeltinin 20 °C’taki buhar basıncı kaç mmHg’dır?
(Suyun 20 °C’taki buhar basıncı 18 mmHg’dır.)
- Cevap: 16,2 mmHg
3. 1,0 molal KNO3 çözeltisinin bir atmosferdeki kaynamaya başladığı sıcaklığı bulunuz. (Suyun kaynama noktası sabiti Kk = 0,51 °C kg/mol)
- Cevap: 101,2 °C
4. 0,1 molal şeker çözeltisinin bir atmosferdeki donmaya başladığı sıcaklığı bulunuz. (Suyun donma noktası sabiti Kd = 1,86 °C kg/mol)
- Cevap: -0,186 °C
“11. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 146” ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































