
11. Sınıf Kimya E Kare Yayınları Ders Kitabı Cevapları Sayfa 207


11. Sınıf Kimya Ders Kitabı Sayfa 207 Cevapları E Kare Yayınları’na ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
11. Sınıf Kimya E Kare Yayınları Ders Kitabı Cevapları Sayfa 207
1. Kimyasal tepkimeler ile tepkimeye giren kimyasal türlerin çarpışmaları arasında nasıl bir ilişki olduğunu açıklayınız.
- Cevap: Kimyasal olarak baktığımızda her tepkime farklı sürelerde gerçekleşir. Kimya biliminde tepkime hızları çok önemli ve büyük bir konudur. Kimya biliminde tepkime hızlarıyla ilgilenen dalına tepkime kinetiği denilir. Hızın genel tanımı kimya özelinde herhangi bir değişiklik göstermez ve “birim zamanda madde miktarındaki değişime” tepkime hızı denilir. Bir kimyasal tepkimenin başlangıç anında ilk önce giren maddelerin yoğunluğu çok olduğu için tepkime hızlı başlar ancak (giren maddelerin yoğunluğu azaldığı için) yavaşlayarak devam eder.
2. Aktifleşme enerjisi nedir? A2 + B2 — 2AB gibi genel bir tepkimeye ilişkin potansiyel enerji-tepkime koordinatı grafiği üzerinde, ileri ve geri aktifleşme enerjisi ile tepkime entalpisini göstererek açıklayınız.
- Cevap: Bu soruyu çözmemizi istiyorsanız yorum bölümüne yazınız.
3. Tepkime hızına etki eden faktörler nelerdir? Bu faktörlerin tepkime hızına etkisini kısaca açıklayınız?
- Cevap:
➜ Madde Cinsi: Tepkime sırasında reaktif maddelerde bağ koparılıp yeni bağ oluşuyorsa tepkimeler yavaş, bağ kopması yoksa (iyonik tepkimeler) tepkime hızlıdır.
➜ Sıcaklık: Sıcaklık arttırılırsa, Kinetik enerji artar. Eşik enerjisine sahip tanecik sayısı artar. Tanecik hızı artar. Etkin çarpışma yapan tanecik sayısı artar. Birim zamanda çarpışan tanecik sayısı artar. Aktifleşmiş kompleks sayısı artar. Tepkime hızı artar. Aktifleşme enerjisi değişmez.
➜ Temas Yüzeyi: Heterojen tepkimelerde katı madde küçüldüğünde temas yüzeyi artar, bunun sonucu birim zamandaki çarpışma sayısı artacağından tepkime hızı artar. Odun talaşının odundan daha hızlı yanması, plaka de- mirin, toz demirden daha geç paslanması bu yüzdendir.
➜ Derişim – Basınç: Tepkime kabının hacmi büyütülüp veya küçültülürse, birim zamandaki çarpma sayısı değişeceğinden tepkime hızı değişir.
➜ Katalizör: Tepkime hızının artmasına neden olan maddedir. Yapı- lan işleme ise kataliz denir.
4. 2S02(g) + 02(g) — 2S03(g) tepkimesinde her bir maddenin ortalama hız ifadesini yazınız.
- Cevap:
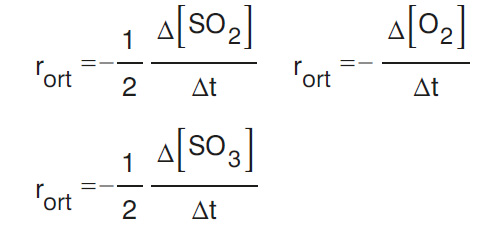
5. 5 L’lik tepkime kabına 0,56 g N2 gazı ve yeterince H2 gazı konularak aşağıdaki tepkime gerçekleştiriliyor: N2(g) + 3H2(g) — 2NH3(g)
200 saniye sonunda tepkimede 0,28 g N2 gazı bulunduğuna göre;
a) Tepkimede N2 gazının ortalama harcanma hızını hesaplayınız (N: 14 g/mol).
- Cevap: 1 ∙ 10–5 mol/L s
b) Tepkimede NH3 gazının ortalama oluşma hızını hesaplayınız.
- Cevap: 2 ∙ 10–5 mol/L s
6. 2NO(g) + F2(g) —- 2NOF(g) tepkimesine ilişkin deneysel sonuçlar aşağıda verilmiştir.
Buna göre aşağıdaki istenilenleri cevaplayınız.
a) Tepkimenin hız denklemini yazınız.
- Cevap: r = k [NO][F2]
b) Tepkimenin mertebesini ve moleküleritesini belirtiniz.
- Cevap: Tepkimenin mertebesi 2, moleküleritesi 3’tür.
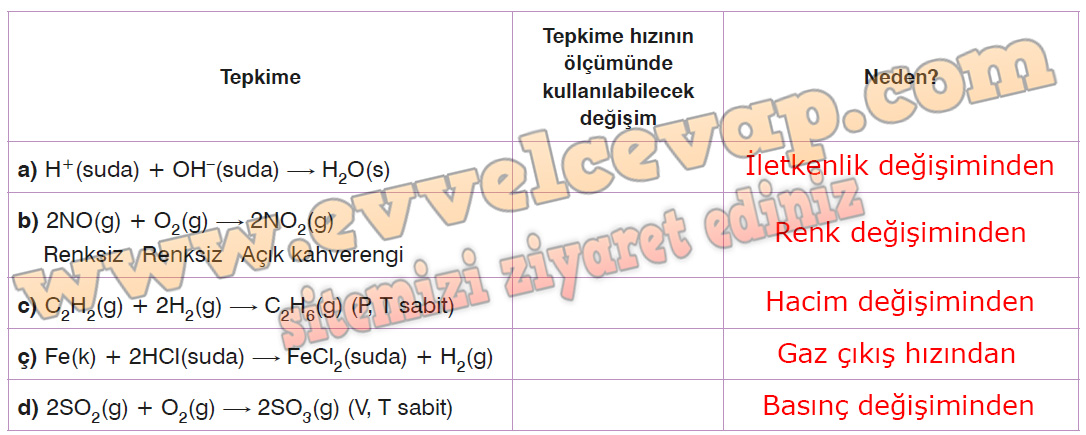
Aşağıdaki tabloda verilen tepkimeleri inceleyiniz. Tepkimelerde hızın ölçümünde kullanılabilecek değişimi yazarak nedenini kısaca açıklayınız.
- Cevap:
11. Sınıf Kimya E Kare Eğitim Ders Kitabı Sayfa 207 Cevabı ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































